Oxidar con agua
Hemos hecho una primera aproximación a la química del agua, analizando cómo es que las particularidades de la estructura química de sus moléculas la hacen una sustancia excepcional, casi "mágica" y fundamental para la vida en el planeta "azul". Recordemos que es su polaridad y su capacidad para formar "puentes de hidrógeno" lo que determina en gran medida su comportamiento

Tomado de: http://www.ehu.es/biomoleculas/agua/agua.htm#pq1
Ahora profundizaremos en la forma que el agua se comporta químicamente frente a otras sustancias. Un primer detalle interesante es que los químicos consideran al agua como una sustancia prácticamente "inerte", esto es, que presenta cierta resistencia a combinarse químicamente con otras sustancias.
De hecho, el agua tiende a "disociarse" o "ionizarse", lo que significa que su molécula se separa con relativa facilidad para formar dos iones (¡casi se comporta como un compuesto iónico cuando sabemos que es covalente!!).
Las moléculas de agua se disocian o ionizan unas con otras debido a que cada molécula se comporta como un imán respecto a las demás (recuerda que el agua es polar). Esto se conoce como autoionización y ocurre millones de veces por milisegundo en una gota de agua.
Pero los dos iones formados: el H+ (ión hidrógeno) y el OH- (ión hidróxido), se unen nuevamente con la misma velocidad con la que se separan y sólo bajo condiciones muy particulares permanecen en estado ionizado.
Al hacer un análisis de este fenómeno los químicos han encontrado que sólo una de cada 107 moléculas de agua puede encontrarse "disociada" (ionizada).

En la ecuación que representa este fenómeno, la flecha de reacción es doble e indica ambos sentidos. Esto significa queel cambio es reversible y que los productos se convierten nuevamente en reactivos en un proceso dinámico que nunca termina.
El fenómeno de disociación del agua es responsable de su alta capacidad para disolver sustanciasiónicas, como las sales, o cualquier otra especie que sea susceptible de ser disociada o ionizada. De manera que cualquier especie química con carga eléctrica que caiga en el seno del agua será "atrapada" y se disolverá.
Por un lado, este hecho convierte al agua en un medio extraordinario para que en ella se realicen otras reacciones químicas. Por ejemplo, la mayoría de las reacciones en los organismos de los seres vivos, se realizan en el ambiente "acuoso" de las células.
Pero por otro lado, su alta capacidad de disolución -es el disolvente universal- también es la causa de que el agua secontamine con facilidad al disolver todo tipo de sustancias peligrosas para el ambiente y la salud: iones de metales pesados, amoniaco, cloro, detergentes, pesticidas, etc.
Las siguientes notas ilustran el hecho, revisa algunas para saber más de este fenómeno (da clic en las imágenes):
Aunque el agua es normalmente inerte (no reacciona) e inocua (no hace daño), existen algunas sustancias químicas que pueden reaccionar con ella, incluso de forma peligrosa porque durante el proceso se genera gran cantidad de calor, porque la reacción es explosiva o porque produce sustancias inflamables, tóxicas o corrosivas.
Saber qué sustancias pueden reaccionar con agua produciendo un efecto negativo es muy importante, por ejemplo en la industria, al almacenar o manipular materia prima debe cuidarse que los envases contengan una leyenda que advierta de la posible reactividad con el agua.
En el hogar, es muy importante saber cuáles productos comerciales no deben ser desechados en el drenaje por la posible reactividad que tengan con el agua. Analizaremos a continuación algunas de estas reacciones.
Reacciones del agua con elementos: agua y metales
El agua puede reaccionar con los elementos de los grupos más "reactivos" de la tabla periódica, que son los que se encuentran en los extremos de la misma: por un lado los metales alcalinos (IA) y alcalinotérreos (IIA), y por otro, los halógenos del grupo VII A:
La reacción de agua con metales produce compuestos con carácter básico llamados hidróxidos, mientras que la reacción con no metales da origen a compuestos de carácter ácido, denominados con el mismo término:


El agua reacciona con los metales más activos para formar bases(o antiácidos), llamadas hidróxidos y liberar hidrógeno gaseoso.
En estos fenómenos, el metal se combina con el ión hidróxido del agua. El metal pierde electrones durante el proceso, de manera que el agua actúa como un agente oxidante.
Analiza las siguientes ecuaciones:

El agua reacciona violentamente con los metales del grupo IA produciendo gran cantidad de calor e inflamando el hidrógeno que se produce. Como ejemplos de este fenómeno puedes ver las reacciones de litio y sodio en los videos:

https://youtu.be/oxhW7TtXIAM
https://youtu.be/q-bJSHOybXU
Un hidróxido es un compuesto en el que se encuentra el ión del mismo nombreOH-1
Ejemplos de hidróxidos son el de calcioCa(OH)2, el de magnesio, Mg(OH)2, y el de aluminio Al(OH)3, que se encuentran en la mayoría de los antiácidos de venta comercial (Melox, leche de magnesia).
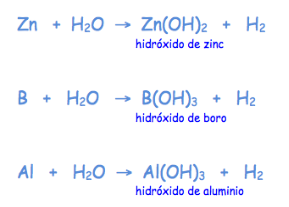
El agua también reacciona con los metales de los grupos IIA y IVB, aunque de forma menos vigorosa, y con otros elementos como el Zn, B, Al y Si si se encuentran muy pulverizados.
Observa en estas ecuaciones:
- Además del hidróxido se produce hidrógeno gaseoso en estas reacciones. ¿Por qué el hidrógeno que se produce tiene en la ecuación un subíndice 2?
- Al escribir la fórmula de los hidróxidos, el ión OH- se escribe entre paréntesis para multiplicar la carga (-1)de este ión por el estado de oxidación del metal correspondiente, de manera que sea posible ajustar el número de cargas positivas y negativas para obtener un compuesto neutro.
Ejercicios:
1. Identifica el grupo OH-1 en cada uno de los hidróxidos que se forman.
2. Observa que estas bases se nombran utilizando el término "hidróxido" seguido del nombre del metal. En caso necesario se utiliza la nomenclatura stock.
3. Analiza las ecuaciones correspondientes y observa que ninguna de ellas está balanceada. Ajústalas escribiendo loscoeficientes necesarios.
4. En estas ecuaciones el agua actúa como agente oxidante. Identifica en cada fenómeno al agente reductor (la sustancia que se oxida).

http://www.alonsoformula.com/inorganica/hidroxidos.htm
¿Cómo sabemos experimentalmente que la sustancia obtenida en una reacción es una base?
Los químicos cuentan con ciertas sustancias, llamadas INDICADORES, que presentan la propiedad de cambiar de color en función del medio en el que se encuentren.
Para identificar una base, el indicador más conocido se llama fenoftaleína. Es una solución transparente que al contacto con una base se vuelve de color fucsia (o rosa mexicano). Da clic en la imagen para observar el procedimiento experimental.
Animación tomada de http://www.canalgif.net/Gifs-animados/Ciencias/Utiles-de-laboratorio/Imagen-animada-laboratorio-19.gif
Tomado de http://www.pontociencia.org.br/experimentos-interna.php?experimento=148#top
Los hidróxidos, especialmente los de los grupos Ia y IIA son sustancias corrosivas que reaccionan con la materia orgánica (la materia viva) destruyéndola, de aquí el impacto ambiental de los metales que se vierten a los mantos de agua.
Reacciones del agua con compuestos: agua y óxidos metálicos
El agua reacciona con muchos compuestos, pero revisaremos su combinación con los óxidos que ya conoces. En este caso, también se forman bases y ácidos, pero de forma más directa (y menos explosiva) que con los metales o no metales. Como recordarás, los óxidos pueden ser metálicos (de carácter básico) o no metálicos (de carácter ácido). Observa qué sucede cuando se combinan con agua. En particular la reacción con óxidos metálicos para formar hidróxidos:

Los hidróxidos tienen amplio uso comercial. En el video podrás observar la reacción de formación del hidróxido de magnesio:

Ejercicios:
1. Balancea estas ecuaciones ajustando la cantidad de átomos antes y después de la reacción utilizando los coeficientes necesarios.
2. Investiga en la red al menos un uso comercial de la sosa cáustica: NaOH, de la cal apagada: Ca(OH)2 y del hidróxido de aluminio: Al(OH)3.
|
Reacciones químicas, el resultado de formar y romper enlaces RECORDEMOS que al formarse un enlace químico entre dos elementos para formar compuestos, o bien, al romperse los enlaces de los compuestos, las sustancias originales PIERDEN TODAS SUS PROPIEDADES y se convierten en algo completamente distinto. A estos fenómenos se les llama CAMBIOS O REACCIONES QUÍMICAS y de ellos depende la gran variedad de transformaciones que observamos en la naturaleza: la fotosíntesis, la oxidación, la fermentación, el envejecimiento, la combustión, la neutralización ácido-base, etc. Da clic en la imagen para saber más acerca de algunos fenómenos químicos cotidianos. Es muy importante saber que los químicos clasifican los cambios de la materia como físicos o químicos: No es fácil reconocer cuándo ocurre uno u otro, pero se pueden diferenciar por la presencia o ausencia de sustancias distintas a las originales. Da clic en la imagen para visitar un sitio donde podrás estudiar esta clasificación:
|
|||||
Las reacciones químicas se representan a través de ECUACIONES QUÍMICAS, por ejemplo, la reacción entre el sodio y el cloro, para formar cloruro de sodio (la sal de mesa), se representa en lenguaje químico de la siguiente manera:

Observa que en la ecuación química:
1. Se escriben los símbolos de los dos elementos que se enlazan químicamente: sodio y cloro. Estos símbolos se escriben ANTES de la FLECHA DE REACCIÓN, lo que indica que se trata de las SUSTANCIAS ORIGINALES. También se les llama REACTIVOS.
2. Se escribe la FÓRMULA que representa al COMPUESTO que se forma al enlazarse químicamente el sodio y el cloro. El compuesto formado se llama cloruro de sodio y al ser la SUSTANCIA NUEVA que se genera con la reacción se le llama PRODUCTO. Observa que esta fórmula se escribe DESPUÉS DE LA FLECHA DE REACCIÓN y en ella se muestran unidos los símbolos de los elementos sodio y cloro.
3. Las imágenes muestran cómo cambian las propiedades de los reactivos al convertirse en productos. El sodio es un metal blando, con brillo, buen conductor del calor y la electricidad y extremadamente reactivo, tanto que explota al contacto con el agua. El cloro es un gas amarillo, tóxico y sofocante. Pero el cloruro de sodio que se obtiene de la reacción de estos dos elementos es el compuesto sólido, blanco, de sabor salado que utilizamos en la cocina para mejorar el sabor de los alimentos, no es tóxico y difícilmente reacciona con otras sustancias.
Recuerda: EN LOS CAMBIOS QUÍMICOS SE PRODUCEN SUSTANCIAS COMPLETAMENTE DISTINTAS A LAS QUE LES DAN ORIGEN
Cuando ocurre una reacción química muchas veces es posible observar la formación de la nueva sustancia, pero también es posible que el cambio ocurra sin que a simple vista se perciba algo. Los químicos utilizan algunos medios indirectos para identificar estos fenómenos, entre ellos:
Visita este sitio y revisa cómo se reconoce un cambio químico. Da clic en la imagen.
http://www.lamanzanadenewton.com/materiales/aplicaciones/lrq/lrq_rq.html
Da clic en la imagen para acceder a material interactivo y revisar particularmente los siguientes conceptos;
a) Concepto de reacción química
b) Ley de la conservación de la materia
c) Concepto de estequiometría
d) Concepto de ecuación química
e) Concepto de reactivos y productos
f) Ajuste o balanceo de una ecuación química
g) Interpretación cualitativa y cuantitativa de una ecuación química
Ajuste o balanceo de ecuaciones
De acuerdo con la Ley de la Conservación de la Materia, establecida por Antonio Lavoisier en el siglo XVIII, en ningún cambio físico o químico de la materia, esta se crea o se destruye, sólo se transforma. Si esto es cierto, entonces, durante una reacción química:
1. Ningún átomo se perderá y/o ningún átomo nuevo aparecerá como resultado del cambio.
2. La cantidad de materia (o masa) en los reactivos, será siempre igual a la cantidad de materia (o masa) en los productos.


Pero si observas, esta representación NO cumple con la Ley de la Conservación de la Materia, pues, mientras en los reactivos se tienen en total tres átomos: 1 átomo de sodio y dos átomos de cloro; en los productos solamente hay dos átomos: 1 átomo de sodio y 1 átomo de cloro.
Tal parece que un átomo de cloro SE DESTRUYE, lo que contradice la Ley. De manera que si la ley es correcta, como toda la evidencia experimental sugiere, entonces lo que debemos corregir es la REPRESENTACIÓN del fenómeno.
Para lograrlo, lo que los químicos proponen es ajustar o balancear la ecuación utilizando coeficientes.
Los coeficientes son números enteros que se escriben ANTES de un símbolo o de una fórmula para "multiplicar" el número de átomos en la representación.
Un coeficiente multiplica tanto símbolos como subíndices, de manera que si se escribe 2Na, se lee: "2 átomos de sodio"; pero escribir 2Cl2 supone leer "4 átomos de cloro". Ahora observa el empleo de coeficientes en la ecuación anterior:


Observa que con el uso de los coeficientes esta representación CUMPLE on la Ley de la Conservación de la Materia, pues, mientras en los reactivos se tienen en total cuatro átomos: 2 átomo2 de sodio y dos átomos de cloro; en los productos también hay cuatro átomos: 2 átomos de sodio y 2 átomos de cloro.
Ningún átomo se ha creado o se ha destruido. Durante la reacción, los átomos solamente se reacomodaron o reagruparon (¿Recuerdas que este es uno de los principios establecidos por Dalton?)
Observa también algo interesante. Durante esta reacción:
a) Se ROMPE un enlace entre los dos átomos de cloro
b) Se FORMAN dos enlaces entre los átomos de sodio y cloro para formar cloruro de sodio.
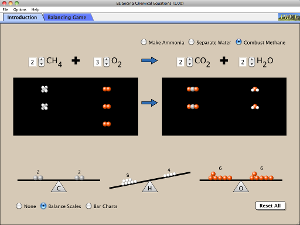
Las reacciones químicas y por tanto, la transformación del mundo, es resultado de la ruptura y/o la formación de enlaces químicos. Practica nuevamente el ajuste o balanceo de ecuaciones en el siguiente interactivo (al dar clic, se descargará en tu computadora una interfaz que podrás manipular):
Revisa las siguientes ecuaciones e indica cuáles de ellas están balanceadas. Para hacerlo cuenta el número de átomos de cada elemento que se representan en los reactivos y en los productos. Guíate por los ejemplos.
Da clic en la tabla para descargar el archivo y trabajar con el documento impreso
 Intenta
balancear por tanteo las ecuaciones que no estén ajustadas. Utiliza coeficientes para hacerlo pues las fórmulas no pueden modificarse en la ecuación.
Intenta
balancear por tanteo las ecuaciones que no estén ajustadas. Utiliza coeficientes para hacerlo pues las fórmulas no pueden modificarse en la ecuación.