¿Oxidar sin oxígeno?
Hemos revisado en la actividad anterior tres fenómenos cotidianos (la corrosión de metales, la formación de gases contaminantes y el envejecimiento) que tienen en común el ser procesos de oxidación. En todos ellos, el agente oxidante es el oxígeno.
Sin embargo, este elemento no es el único agente químico que puede oxidar a otros materiales. En la naturaleza existen muchos y diversos agentes oxidantes.
Y de hecho, es posible generalizar el que los NO METALES actúan como agentes oxidantes cuando se enfrentan químicamente a un METAL.
Como ya sabes, la unión química entre un metal y un no metal da origen
a c ompuestos
iónicos; en este caso, reciben el nombre de SALES BINARIAS (porque están formadas por dos elementos).
ompuestos
iónicos; en este caso, reciben el nombre de SALES BINARIAS (porque están formadas por dos elementos).
Existen miles de sales en la naturaleza, pero tal vez la sal binaria mas conocida es la "sal de mesa", que utilizamos para darle sabor a los alimentos.
En la sal de mesa el metal es sodio y el no metal es cloro: NaCl. Su nombre químico es cloruro de sodio. En la Actividad 5 de Química y Entorno revisaste un documental sobre este compuesto ¿recuerdas lo que aprendiste acerca de él en ese momento?
Propiedades físicas
Al ser compuestos iónicos, las sales son sustancias con aspecto cristalino, sólidas y con altos puntos de fusión y ebullición.
Muchas de las sales binarias tienen sabor salado, se disuelven en agua a temperatura ambiente y las mezclas
formadas (sal-agua) son excelentes conductoras de la  electricidad. Por esta propiedad se les llama electrolitos.
Tal vez has consumido alguna bebida para "hidratarte", estos productos son ricos en
sales (por cierto ¿sería correcto decir que las sales son sodio, potasio,
calcio, etc.?)
electricidad. Por esta propiedad se les llama electrolitos.
Tal vez has consumido alguna bebida para "hidratarte", estos productos son ricos en
sales (por cierto ¿sería correcto decir que las sales son sodio, potasio,
calcio, etc.?)
Las sales son los componentes fundamentales de los minerales que se encuentran en la corteza
terrestre, es posible por tanto obtener estos compuestos por procesos simples de recuperación directa de la naturaleza. La mayoría de los minerales son
mezclas, normalmente formados de óxidos metálicos, sales y elementos "capturados" en la red cristalina, que proporcionan un colorido interesante a estos
materiales.
(Si te interesa saber más, da clic en las imágenes para ir a
videos que profundizan en los conceptos "mineral" y "electrolito").
Imágenes tomadas de http://t0.gstatic.com/images?q=tbn:ANd9GcRhWAKbyG8RmZtieM-Rd8nNILZ97P-OIBG9umwgWcxhmpqDct y
http://t3.gstatic.com/images?q=tbn:ANd9GcTwWzEDYatHFSmnpyOwpJsujpYDSW7qYR9M6Ul3hQRrWy_MicgJgst-9tL4
Síntesis (formación) de sales binarias
En la formación (o síntesis) de SALES BINARIAS, el metal actúa como agente reductor (pierde electrones), mientras que el NO METAL actúa como agente oxidante:

Reacciones de síntesis de sales binarias
Analiza las siguientes ecuaciones de síntesis de sales binarias. Son reacciones de oxidación. (El término correcto es oxido-reducción, pues la pérdida de electrones para una especie química supone ganancia para otra).


Observa que los elementos F2, Cl2, Br2, I2 y N2 son diatómicos en estado libre (cuando están sin combinar con otro elemento): siempre que participen en una ecuación química como elementos, deben escribirse con el subíndice 2.
Observa que al combinarse con el metal, estos elementos pierden ese subíndice para ajustar el número de sus átomos a la nueva sustancia química (la sal) que se forma.
1. Cuenta el número de átomos en los reactivos y los productos en cada ecuación. Contrasta lo que sucede entre las formas A y B.
¿En cuál de las dos formas el número de átomos de cada elemento ANTES de la reacción es igual al número de átomos de cada elemento DESPUÉS de la reacción?
¿Cuál de estas dos formas cumple con la Ley de la Conservación de la Materia?
¿Cuál es la forma más adecuada de escribir estas ecuaciones para cumplir esta Ley?
2. Los números que se escriben antes de algunos símbolos o fórmulas en la FORMA B, se llaman coeficientes. Se escriben para balancear la cantidad de átomos en los reactivos y productos para que la ecuación represente el cambio química SIN PÉRDIDA NI GANANCIA DE ÁTOMOS.
Un coeficiente multiplica el número de átomos de cada uno de los elementos de la fórmula que le precede. Por ejemplo, la notación 2NiF3 de la tercera ecuación indica que hay 2 átomos de níquel y 6 átomos de flúor (al multiplicar el coeficiente 2 por el subíndice 3 de este elemento).
¿Cómo determinarías los coeficientes de cada sustancia para balancear correctamente las ecuaciones? Haz una propuesta de mecanismo para hacerlo. Intenta balancear cada una de las ecuaciones de la forma A para llegar a las de la forma B.
3. Observa las ecuaciones donde interviene el cobre como reactivo (Cu). Nota que este metal puede formar dos sales distintas: CuI y CuI2
4. Recuerda que en estas ecuaciones los NO METALES son los agentes oxidantes.
Si aún tienes problema para entender este tema, revisa los interactivos que se descargan al dar clic en las imágenes. Estudia en ellos cómo balancear (o ajustar) ecuaciones químicas:
¿Cuáles son los estados de oxidación del cobre y el yodo en ambos casos?
¿Cuáles son los estados de oxidación del fierro (Fe) y el azufre (S) en las dos sales que forman?
¿Qué elementos actúan como agentes oxidantes? Identifícalos en cada ecuación.
¿Qué elementos actúan como agentes reductores? Identifícalos en cada ecuación.
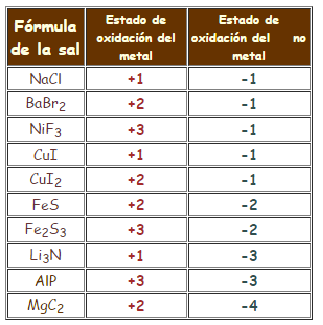
Para determinar los estados de oxidación de cada elemento en las sales que se forman puedes auxiliarte de las tablas que econtrarás al dar clic en la imagen. Observa que existen elementos que solamente presentan un estado de oxidación, mientras que otros pueden exhibir más de uno (es decir, el estado de oxidación es variable porque pueden perder diferente número de electrones).

Cuando en la sal está presente algún elemento con estado de oxidación variable, es necesario calcular el que presentan en la fórmula, considerando que la suma de cargas positivas y negativas debe ser cero.
Calcula los estados de oxidación de cada elemento en las fórmulas de sales analizadas arriba y compara tus resultados con los de la tabla.
Recuerda que la suma de cargas positivas y negativas en un compuesto debe ser cero, y que para obtener los subíndices debes analizar si los estados de oxidación son a) iguales; b) par-impar; c) par-par.
Nomenclatura de sales binarias
Al nombrar sales binarias (también llamadas neutras) es posible utilizar las nomenclaturas tradicional, sistemática y stock, pero en todas ellas la terminación característica es -URO, sufijo que se agrega siempre al No metal. Observa cómo se nombrarían las sales formadas en las ecuaciones anteriores:

Estudia la nomenclatura de sales binarias en el sitio web que se despliega al dar clic en la imagen. Contesta también los ejercicios interactivos de escritura fórmulas que encontrarás al dar clic en cada celda de la siguiente tabla. Recuerda que es necesario practicar mucho para dominar este nuevo lenguaje:
Fuente de ejercicios: Alonso, Q. (actualización 12/1/2013). Formulación de Química Inorgánica (en español). Disponible en www.alonsoformula.com
El uso de las sales en la vida cotidiana
Las sales tienen amplio uso como materia prima en la industria o como productos de aplicación cotidiana diversa. Sólo para darte algunos ejemplos, los compuestos que hemos estudiado en esta actividad se utilizan de la siguiente manera:
Actualmente existe una preocupación creciente por la relación que existe entre el consumo de sal en los alimentos (especialmente los procesados) y algunas enfermedades de impacto en la población, como la hipertensión arterial o la obesidad. Es aquí donde saber un poco más de la química de estas sustancias puede ayudarnos a tomar mejores decisiones respecto a su uso cotidiano.


Video tomado de http://www.youtube.com/watch?v=WLD6Ac9LOzg
Video tomado de http://www.youtube.com/watch?v=-Yb56WLGsfk
Cómo determinar los estados de oxidación en una fórmula química
https://youtu.be/9eb0lhkL2NY
